病毒作为一类严格的胞内寄生物,完全依赖于宿主的翻译系统合成病毒蛋白从而实现病毒的快速复制,其复制过程也会造成细胞损伤的发生,引发一系列细胞生物学事件。近日,中国农业科学院上海兽医研究所丁铲团队在国际学术期刊PLOS Pathogens在线连续发表两篇最新的研究论文:“Newcastle Disease Virus Infection Activates PI3K/Akt/mTOR and p38 MAPK/Mnk1 Pathways to Benefit Viral mRNA Translation via Interaction of the Viral NP protein and Host eIF4E”和“ATM-mediated DNA double-strand break response facilitated oncolytic Newcastle disease virus replication and promoted syncytium formation in tumor cells”。研究表明:新城疫病毒(NDV)感染宿主细胞后,病毒编码的NP蛋白通过与宿主翻译起始因子eIF4E互作,实现病毒mRNA的优先翻译,并限制宿主细胞蛋白翻译。另外,NDV在细胞中的迅速复制激活ATM依赖的双链DNA断裂反应(DSBs),NDV强毒株编码的HN和F蛋白协同诱导的膜融合过程激活ATM依赖的DSBs,促进NDV介导靶向杀伤肿瘤细胞。


新城疫病毒(Newcastle disease virus, NDV),属于副黏病毒科,单股负链RNA病毒,可以编码六种结构蛋白(NP、P、M、F、HN和L)和两种非结构蛋白(V和W)。NP(核衣壳蛋白)包裹病毒基因组,在NDV基因组复制,mRNA转录等过程中发挥重要作用;HN(血凝素-神经氨酸酶蛋白)和F(融合蛋白)定位于病毒囊膜,介导NDV强毒株诱导的细胞融合,由NDV引起的新城疫仍是危害养禽业最大的禽病之一。除了对禽类具有致病性之外,NDV还能够特异性地在人类肿瘤细胞中复制,通过外源性和内源性凋亡途径诱导肿瘤细胞死亡,具有溶解肿瘤的病毒学特性,深入揭示NDV复制机理对抗病毒和抗肿瘤疗法都具有重要意义。 宿主的真核翻译系统也是病毒感染过程中重要的调控靶标,该研究首先通过放射自显影技术证实NDV感染后可以选择性抑制宿主蛋白的合成,而宿主的真核翻译系统以及相关的PI3k/Akt/mTOR和p38 MAPK/Mnk1调节通路迅速被NDV感染所激活,NDV mRNA是帽子结构依赖翻译。进一步研究发现,NDV编码的NP蛋白经与宿主翻译起始因子eIF4E直接结合,抑制以1型帽子结构为主的宿主mRNA翻译,优先翻译NDV 0型帽子结构的mRNA;NP蛋白还被招募到多聚核糖体中,直接参与宿主的真核翻译延伸过程的调节。这是一种新发现的病毒蛋白翻译机制(图1)。
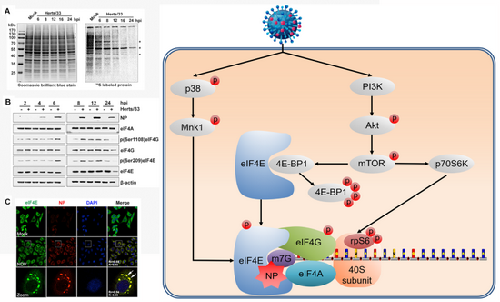
图1 新城疫病毒劫持宿主翻译系统
此外,该团队发现,NDV在细胞中的复制会激活ATM依赖的双链DNA断裂反应(DSBs),使用靶向抑制ATM激酶的药物处理后能抑制病毒感染诱导的DSBs。有意思的是,该研究首次揭示NDV强毒株HN和F蛋白共转后诱导细胞融合,该膜融合过程也能激活ATM依赖的DSBs。进一步的研究证实了NDV感染和F-HN诱导的膜融合过程能通过激活MRN复合物作为DSB的感受器,促进ATM依赖的DSBs。靶向抑制ATM依赖的DSBs能够明显抑制NDV在肿瘤细胞中的复制和膜融合形成能力(图2)。
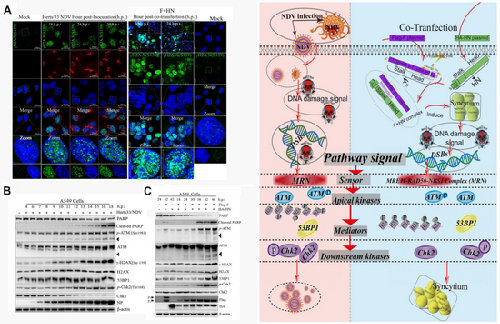
图2 新城疫病毒和HN-F介导的细胞融合诱发DNA损伤
该团队此前的研究结果表明NDV能够利用细胞自噬和应激颗粒等细胞应激反应促进病毒复制。此次首次阐释了NDV劫持宿主翻译系统和诱导DNA损伤、协助病毒高效复制的新机制。重要的是,NDV结构蛋白如何参与病毒复制机制不清,上述结果揭示了病毒结构蛋白NP,HN和F的新功能,为阐明NDV和其它副黏病毒的复制机制提供理论依据,也拓展了我们对于NDV与宿主细胞互作的理解,对于更好地改造溶瘤NDV提供了新的视角。 中国农业科学院上海兽医研究所博士生詹媛和任善会分别为论文的第一作者,丁铲研究员、孙英杰副研究员为共同通讯作者。该研究得到了国家自然科学基金重点基金、国家“十三五”重点研发计划和中国农业科学院科技创新工程等资助。
论文链接: https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1008610 https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1008514